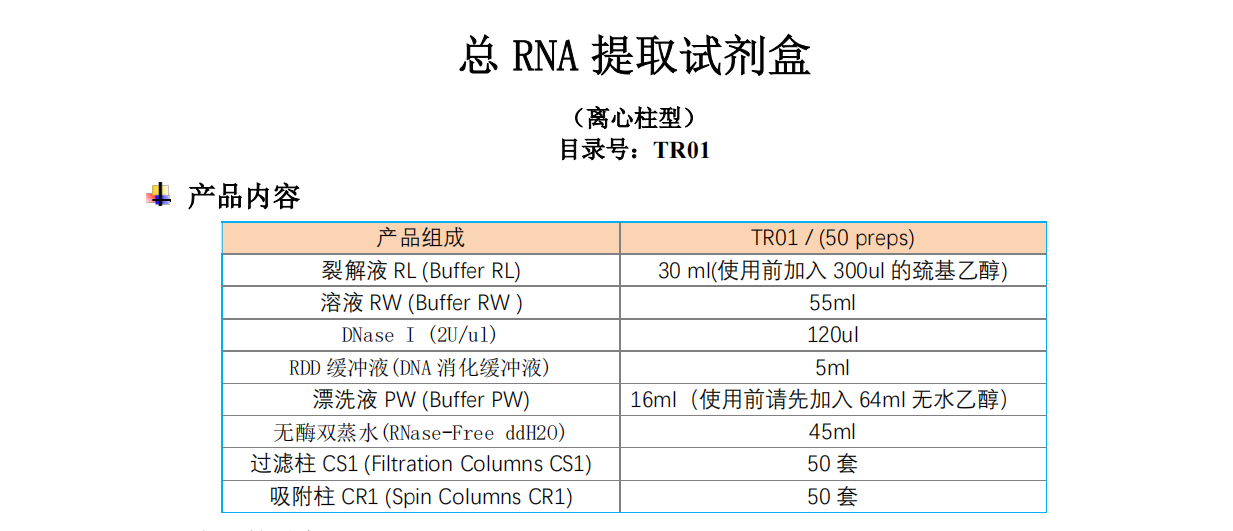
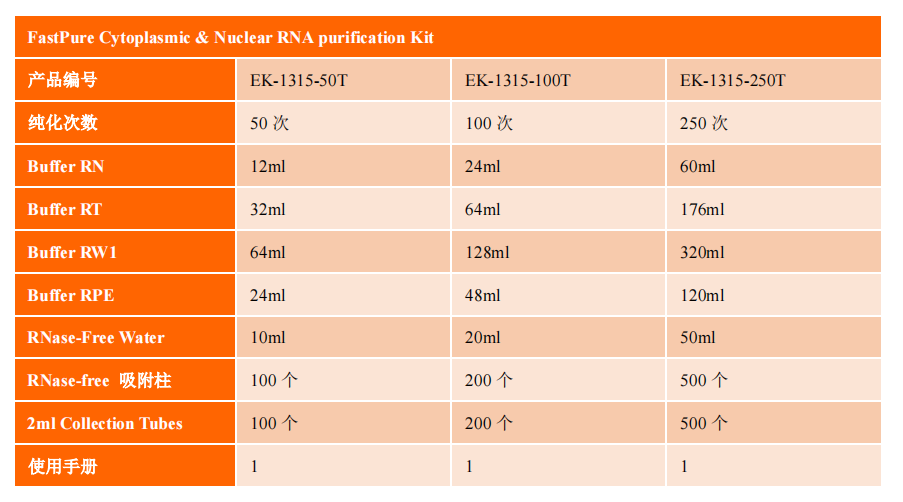
细胞质与细胞核RNA小量提取试剂盒250T品牌:JinPan | 货号:EK-1315-250T
FastPure Cytoplasmic & Nuclear RNA purification Kit HandBook
FastPure 细胞质和细胞核 RNA 小量提取试剂盒说明书
产品组成
产品介绍
本试剂盒可以快速地从哺乳动物细胞或组织中提取细胞质或细胞核 RNA,不含酚氯仿等有毒试剂。
其提取的总 RNA 纯度高,无蛋白质及其它杂质污染,可用于 RT-PCR、Real Time RT-PCR、mRNA 差异
显示、分子克隆等多种下游实验。本产品仅供科研使用,请勿用于医药、临床治疗、食品级化妆品等用
途。
存储条件
Buffer RN 置于 2-8℃保存;Buffer RT 可室温(15℃-25℃)干燥放置至少一年,加入 β-巯基乙醇(或
DTT)的 Buffer RT 可室温放置一个月;其他试剂室温干燥保存可至少稳定 12 个月。
需要额外准备的材料
14.3 M β-巯基乙醇(β-ME) (常规购买商业化商品即为 14.3 M)或 2M DTT
70%乙醇:RNase-Free 水配制
无水乙醇(96%-100%)
无酶 1.5ml 离心管
无酶吸头
干净的手套
高速离心机
物理研磨设备
开始前注意事项 请务必在使用本试剂盒之前阅读此注意事项。
操作前在 Buffer RT 中加入 β-巯基乙醇(
β-ME)至终浓度为 1%(建议现配现用),如 1 ml Buffer RT
中加入 10μl β-巯基乙醇(或加入 20 µl 的 2 M DTT)。配好的 Buffer RT 可在 4℃维持稳定一个月。
Buffer RT 在储存时可能会形成沉淀,如果有沉淀出现,请 37℃加热溶解后室温使用。
Buffer RW1 作为浓缩液提供,在第一次使用前加入 0.25 倍体积的乙醇(96-100%)以获得工作溶液。
Buffer RPE 作为浓缩液提供,在第一次使用前加入 4 倍体积的乙醇(96-100%)以获得工作溶液。
如果执行可选的柱上 DNA 酶消化步骤,请制备 DNase I 储备液:将 DNase I 干粉(1500 U)溶解在
550μl RNase-Free ddH2O 中,轻柔混匀(禁止涡旋),分装后-20℃贮存(可保存 9 个月)。
RNase-free 水中不含任何抑菌因子,室温放置或操作时可能会引入细菌或真菌污染,使用时尽量注意,
推荐开瓶后分装保存以减少污染风险保证实验稳定性。
RNA 在 Buffer RT 中时不会被 RNase 降解。但提取后继续处理过程中应使用不含 RNase 的离心管或玻
璃器皿。
RNA 提取操作及离心过程常温进行即可。
操作步骤:
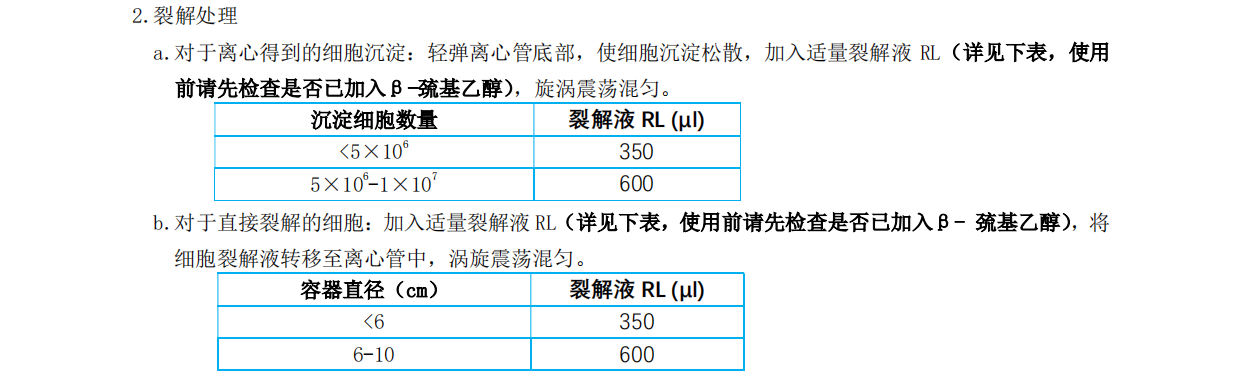
1.请根据样品种类进行以下步骤(1a 为动物细胞,1b 为动物组织)
1a. 收集动物细胞: 悬浮细胞可直接 300×g 离心 5min 并仔细吸除上清留沉淀待使用;
单层贴壁细胞可通过直接裂解法(吸尽培养基留下贴壁细胞,待步骤 2 用 Buffer RT
裂解)或胰酶处理法(吸尽培养基留下贴壁细胞,用 PBS 清洗细胞,吸除 PBS 后
使用含 0.10%-0.25%胰酶的 PBS 使细胞脱落,加入含有血清的培养基使胰酶失活后
转入无酶 1.5ml 离心管中 300×g 离心 5min,吸除上清留沉淀待使用)
注意:收集细胞数量不要超过 1×107,收集细胞时一定要将细胞培养基去除干净,否则会导致步骤 2 时细胞裂解
不完全,影响 RNA 与吸附柱的结合,RNA 的产量降低。
1b. 动物组织匀浆处理: 将 10mg-30mg 动物组织转移入无酶 1.5ml 离心管中并加入
600μl Buffer RT(动物组织量不要超过 30mg)使用前请检查 Buffer RT 是否加入 β-
巯基乙醇,使用研磨杵或电动研磨机将动物组织彻底研磨匀浆。直接进行步骤 3.
2.加入 4℃预冷的 180μl Buffer RN 至细胞沉淀中,并于冰上孵育 5min。对于未消
化收集的培养在 3.5cm 培养皿中的细胞,可吸净培养基用 PBS 清洗一次后,直接
加入 4℃预冷的 180μl Buffer RN 至细胞培养皿中,然后用细胞刮刀轻轻刮动并转
移至无酶 1.5ml 离心管中,并于冰上孵育 5min。
对于提前离心沉淀在离心管中的细胞,通过轻弹离心管以使细胞沉淀彻底分散开。悬浮液应迅速澄清,表明质膜
立即溶解。注意:细胞沉淀的不完全分散可能导致裂解效率低下和 RNA 产量降低。
3.将上述裂解物在 4ºC 下以 300×g 离心 2min。将上清液转移到新的无酶 1.5ml 离心
管中用于细胞质 RNA 提取,沉淀用于细胞核 RNA 提取。如果在此过程的后续步
骤中使用相同的离心机,则保持离心室温状态。
上清液含有细胞质提取物。根据细胞类型的不同,它通常略带混浊和黄白色。沉淀含有细胞核,上清中为细胞质裂解物。
4.于步骤 3 种所得细胞质裂解物及细胞沉淀管中分别加入 600 µl Buffer RT(使用前
请检查 Buffer RT 是否加入 β-巯基乙醇或 DTT),充分涡旋混匀。
若沉淀物较多,可室温裂解 3-5min,期间摇匀 2-3 次
5.将 430μl 无水乙醇(96–100%)分别加入两管裂解物中,并用移液器将其充分混
合。 不要离心。
注意:从某些细胞系纯化 RNA 时,加入乙醇后可能会出现沉淀。 这不会影响后续提取过程。
6.将步骤 5 混匀后的两管溶液转移入无酶吸附柱中并套上 2ml 收集管,≥8000×g
(≥10,000rpm)离心 1min,弃废液,直至将溶液全部转移完成吸附。
吸附柱最大上柱量为 700μl,若溶液过多可分多次上柱。后续操作若无特殊说明吸附柱均置于 2ml 收集管中。
7.(可选步骤) 向吸附柱中央加入 80μl DNase Ⅰ 工作液,室温(15℃-25℃)静置
15min。配制 DNase Ⅰ 工作液: 取 10μl DNase Ⅰ储备液入新的 RNase-Free 离心
管中,并加入 70μl Buffer RDD,轻柔混匀。
注意:DNase Ⅰ 对物理变性特别敏感,所以混匀时请上下倒置轻柔混匀,切勿涡旋。请确认 DNase Ⅰ 工作液加入
到正中央的柱膜上,否则 DNase 消化效果会不理想。
8.向两个吸附柱中分别加入 700μl Buffer RW1,≥8000×g(≥10,000 rpm) 离心 30s,
弃废液。
9.将两个吸附柱重收套回收集管中,向吸附柱中加入 500μl Buffer RPE(使用前请
确认 Buffer RPE 按要求加入 4 倍体积无水乙醇),≥8000×g(≥10,000 rpm) 离心
30s,弃废液。
注意区分细胞质与细胞核 RNA 的吸附柱
10. 重复步骤 9 一次。
11. 倒弃滤液,将吸附柱放入收集管中, 以最大转速(~13,400×g)离心 3min 干燥柱子。
12. 将两个吸附柱分别套入新的 RNase-Free 的 1.5ml 离心管中,并置于无 RNA 酶的
环境中开盖静置 5-10min 至乙醇晾干。
若吸附柱中残留乙醇将会对纯化后的 RNA 的下游实验造成影响。
13. 向两个吸附柱膜正中央分别加入 30-50μl RNase-Free Water,盖上盖子室温静置
3-5 min。后置于离心机中 ≥12,000×g(≥13,000 rpm) 离心 3min 得到 RNA 溶液。
RNA 洗脱体积不应少于 30μl,否则影响洗脱效率。洗脱后的 RNA 溶液应置于-80℃储存。
本网站可提供的所有产品和服务均不得用于人体或动物的临床诊断或治疗,仅可用于科研等非医疗目的。